
Ligação Covalente, Iônica e metálica
Teste seu conhecimento em química. Feito por alunas do 9 ano Sol.
0
0
0
Anúncios
1
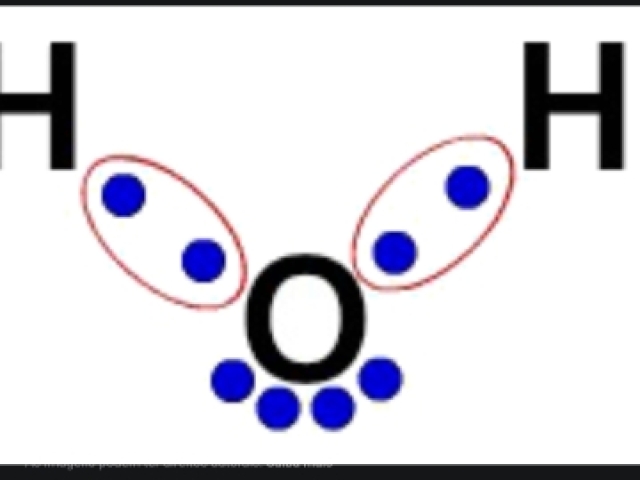
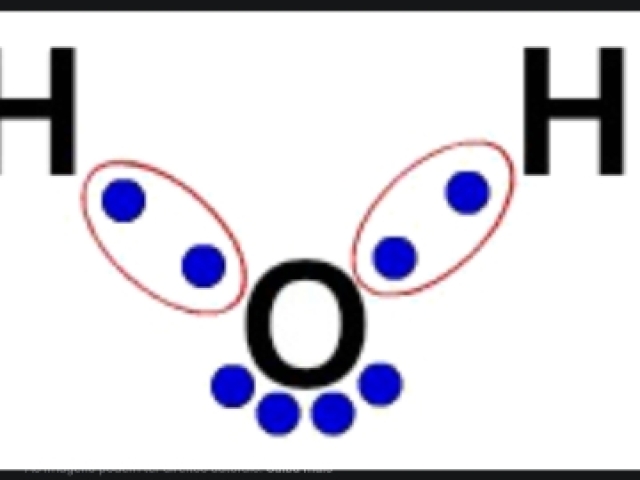
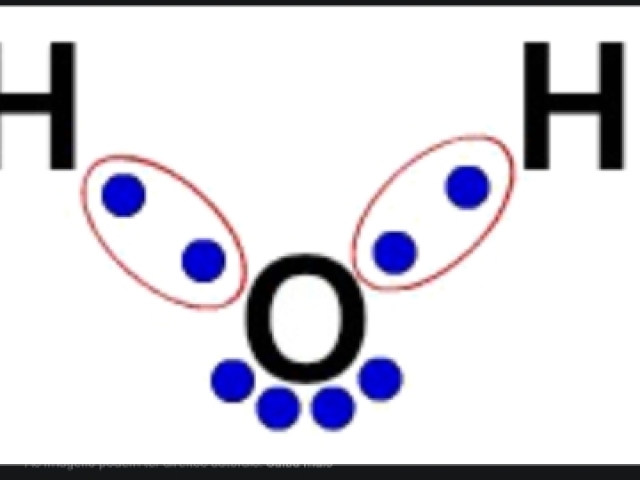
Que tipo de ligação química está representada na imagem ?

Covalente
Metálica
Iônica
Covalente dativa
2
Qual a principal característica de uma ligação covalente ?
Ocorre entre ametais
Ocorre a doação de elétrons
Ocorre entre metais
Ocorre entre metais e ametais
3
Os átomos podem fazer ligações iônicas, covalentes e metálicas para ficarem estáveis. Sobre ligação iônica, assinale V apra verdadeiro e F para falso: a) ocorre entre um cátion e um ânion b) ocorre somente entre não metais c) acontece com compartilhamento de pares de eletrons d) é uma ligação extremamente polar devida a forte atração entre os íons de cargas opostas e) se dá por transferência dos elétrons f) acontece apenas entre átomos que possuem tendência a perder elétrons
V F F V V F
F V V V F F
V F V V F F
V F F V V F
4
Um átomo neutro contém 5 elétrons na última camada. Sua tendência eletrônica, em uma ligação iônica, será:
Ganhar elétrons
Perder elétrons
ganhar ou perder elétrons, indiferentemente.
compartilhar elétrons.
5
Assinale a alternativa a seguir que só apresenta substâncias formadas por ligações metálicas:
Al, Cgrafita, Ag, Au.
Au, O2, Zn, P4.
Au, Pt, N2 e Zn.
Ag, Al, Cu, Au.
S8, NaCl, SF6, Cu.
6
A propriedade que todo metal possui de conduzir calor deve-se:
ao ponto de fusão baixo.
à ruptura das ligações metálicas.
à existência de elétrons livres.
ao núcleo dos átomos dos metais, que possui um número muito grande de prótons.
à existência de prótons livres.















