
equilíbrio químico 2 ano 2 Reg.
Trabalho de química: escola: ESEDRAT Viçosa-mg alunos: Thaciana, Alessandra, Geovana.
0
0
0
Anúncios
1
Um equilíbrio químico e a situação em que as velocidade das reações direta e inversa são iguais. Sendo um fenômeno que acontece nas reações químicas reversíveis entre reagentes e produtos.
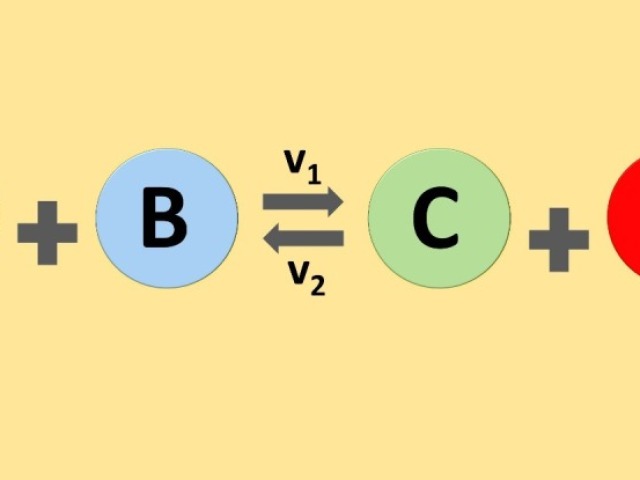
verdadeiro
falso
2

São exemplos de equilíbrio;
partículas barra articulada ,mecânica.
corpo mecânico , molecular,corpo rígido.
Corpo mecânico, corpo rígido, partículas.
3
nas condições ambientais, e um exemplo de sistema de estado de equilíbrio :
tigela contendo feijão cozido
chama uniforme de bico de bunsem
porçaos de água fervendo em temperatura constante
garrafa de água mineral gasosa fechada
xícara de café bem quente
4
o que são reações reversíveis:
as reações reversível processam se em um sentido só.
são reações que não regenera os seus reagentes.
as reações reversíveis são aqueles em que os reagentes são regenerados pela reações entre os produtos.
5
quais são as condições para ocorrer o equilíbrio químico.
a temperatura do sistema for mantida constante.o sistema for fechado isto , é , não realizar trocas de matérias com ambiente
a temperatura do sistema for mantida alta, e o sistema for aberto.
nenhuma das alternativas
a temperatura estiver em 0 , e nao realizar trocas de calor
6
a dupla seta (↔️) em uma reação quer dizer que :
nenhuma das alternativas
corresponde a reação inversa.
corresponde a reação direta.
indica que é um processo reversível.
7
o que é um deslocamento de um equilíbrio químico:
É a mudança na pressão do ambiente, na concentração de um participante.
É a mudança da temperatura do ambiente.
É a mudança do volume de um produto.
É a mudança do produto do sistema.
8
A mudança na temperatura de um participante da reação é um fator que pode promover o deslocamento de um equilíbrio químico. De uma forma geral , segundo o principio de Thomas Edílson.
verdadeiro
falso
9
marque as alternativas corretas:
aumento da pressão: o equilíbrio desloca-se no sentido de maior volume.
Na diminuição da temperatura: o equilíbrio desloca se no sentido da reação endotérmica.
diminuição da concentração: o equilíbrio desloca-se no mesmo sentido do participante.
10
São tipos de equilíbrio químico:
sistemas homogêneos, sistemas gasosos , soluções, sistemas heterogêneos.
sistemas gasosos , reagentes, sistemas heterogêneos.
sistemas homogêneos, sistemas atômicos , soluções.















